Ätiologie
Noch immer (2026) sind die Entstehungsbedingungen und Ursachen der ADHS nicht vollständig geklärt. Die Ätiologie der ADHS ist seit vielen Jahren Gegenstand kontroverser Diskussionen, insbesondere, da sich das störungsspezifische pathophysiologische Gefüge der ADHS derzeit noch nicht ausreichend fundiert beschreiben lässt und da zahlreiche auch neurobiologische Befunde[2][3][4][5][6][7] ebenfalls bei anderen psychiatrischen Störungen zu erheben sind.[8] Gemeinhin anerkannt, jedoch nicht unumstritten, ist das sogenannte biopsychosoziale/multifaktorielle Entstehungsmodell[9], das besagt, dass das Störungsbild in mehr als der Hälfte der Fälle auf genetische und exogene Beteiligungsfaktoren zurückzuführen ist.[10] Ein vollständiges und zugleich stimmiges Entstehungsmodell zur ADHS existiert aktuell jedoch nicht.[11]
Mit einem Forschungsprojekt, welches mit Geldern aus einem Fonds über 6 Millionen Euro finanziert wird, hat das Universitätsklinikum Frankfurt im Jahr 2016 mit Arbeiten zur genaueren Erforschung der Ursachen und Behandlung der ADHS begonnen.[12]
Risikofaktoren
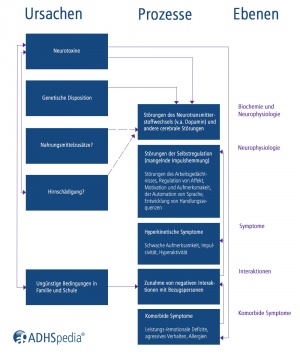
Im Rahmen des geheimhin anerkannten multifaktoriellen Entstehungsmodells werden verschiedene genetische und exogene Einflussfaktoren diskutiert, die für die Entstehung der Störung in Frage kommen können.
Genetische Risikofaktoren
→Siehe Hautpartikel: Genetik der ADHS.
Zwillings-, Familien- und Adoptionsstudien weisen darauf hin, dass genetische Faktoren einen überwiegenden ätiologischen Anteil an der Disposition ausmachen.[13][14] Dies würde bedeuten, dass die Wahrscheinlichkeit, ob ein Mensch im Laufe seines Lebens ADHS-Symptome entwickelt, maßgeblich durch genetische Faktoren mitbeeinflusst wird. Aktuell wird davon ausgegangen, dass unabhängig davon, ob ADHS als abgegrenzte Störungskategorie oder in seinen drei Kerndimensionen gefasst wird, etwa 20 %[15] bzw. 60-90 % der phänotypischen Varianz auf genetische Faktoren zurückgeführt werden können. Eltern, Geschwister und andere Verwandte haben ein etwa drei- bis fünffach erhöhtes Risiko ebenfalls an ADHS zu erkranken, wobei biologische Eltern etwa sechsmal häufiger an ADHS leiden, als Adoptiveltern.[16][17]
Als wahrscheinlich gilt unter anderem die ätiologische Beteiligung von Polymorphismen in diversen Genen, darunter die Dopamin-Rezeptor-Gene DRD-4 und DRD-5 sowie das Dopamintransporter-Gen, deren ätiologische Beteiligung derzeit am besten belegt ist. Das DAT-1 könnte dabei wesentlich für die angenommene geringere Verfügbarkeit von Dopamin im synaptischen Spalt verantwortlich sein, da bestimmte Allele in diesem mit einer erhöhten präsynaptischen Dichte des Dopamin-Transporters einherzugehen scheinen.[18] Einige Kritiker, darunter François Gonon, fordern hierfür jedoch weitere Belege.[19]
Die genannten genetischen Polymorphismen erklären nur etwa 5 % der genetischen Verhaltensvarianz und gehen nur mit einer geringen Risikoerhöhung für ADHS einher (1.2 bis 1.9-fach), weshalb es als unwahrscheinlich gilt, dass das Auftreten einer ADHS auf die Veränderung eines einzelnen Gens zurückzuführen ist. Als wahrscheinlicher gilt im Sinne einer multifaktoriellen genese eine Wechselwirkung verschiedener Gene oder zwischen genetischen und exogenen Faktoren.[20] Auch wenn sich zunächst keine Symptome zeigen, kann beim Invididuum eine Disposition vorliegen, die durch exogene Einflüsse das klinische Bild modifizieren kann.[21]
Exogene Risikofaktoren

Psychosoziale Bedingungen
Familiäre Vernachlässigung, Deprivation, psychosozialer Stress, aversives Erziehungsverhalten und andere negative psychosoziale Einflussfaktoren sind ätiologisch relevant und können bedeutenden Einfluss auf die Entstehung und Ausweitung einer ADHS-Symptomatik haben. Auch Veränderungen im familiären Umfeld oder gravierende Veränderungen der gewohnten Alltagsroutine, wie häufige Umzüge, der Verlust eines Elternteils oder die Geburt eines Geschwisterkindes gehen mit einer signifikant erhöhten Wahrscheinlichkeit einer ADHS-Symptomatik einher.[22]. Die genannten psychosozialen Risikofaktoren sind jedoch keineswegs spezifisch für die ADHS, sondern führen generell zu einer Beeinträchtigung der seelischen und sozialen Entwicklung von Kindern.[23]
Soziale Deprivation und Missbrauch
Per se führen Erziehungsfehler, Vernachlässigung und Missbrauch für sich gesehen nicht zu ADHS. Komorbide ADHS-Symptome, etwa bei (komplexen) posttraumatischen Belastungsstörungen oder Bindungsstörungen werden jedoch häufig beschrieben[24][25], sind oftmals nicht klar abzugrenzen und führen nicht selten und insbesondere bei wenig sorgfältigem diagnostischen Vorgehen zu falsch-positiven ADHS-Diagnosen. Sowohl bei ADHS, als auch bei Folgestörungen von Deprivation imponieren die mangelnden Selbstregulationsfähigkeiten besonders deutlich, was das Fehldiagnose-Risiko erhöht.
Von familiärer Gewalt und Missbrauch in Familien mit ADHS wird gehäuft berichtet. Die Gewalt wird dabei bisweilen „syndromtypisch" als Bestandteil der ADHS-Problematik betrachtet. Die Möglichkeit, familiäre Gewalt, Deprivation oder Missbrauch im Rahmen der ambulanten Diagnostik auszuschließen, ist jedoch oftmals nicht in ausreichendem Maße gegeben.
Bindung
Positive Bindungserfahrungen können nach Shore als ein Produkt geglückter „right-brain-to-right-brain-communications“ aufgefasst werden.[26] Grundlage hierfür bilden eine angenommene Synchronizität der Interaktion zwischen dem Kind und der primären Bindungsperson, etwa der Mutter, sowie die Interaktion physiologischer Rhythmen (arousal-regulation transactions). Dabei wird deutlich, dass das positive Verhalten der Bindungsperson als externe Modulationshilfe wirkt, etwa hinsichtlich der Regulation eigner Affekte, Vorhersehbarkeit von Reaktionen etc.), wodurch eine Beeinflussung der sich entwickelnden Kortexareale erfolgt, welche die Grundlage für die Ausbildung interner Bindungsrepräsentationen und sozialer Adaptionsleistungen schaffen.[27]
Des Weiteren konnten tierexperimentelle Untersuchungen erhebliche Langzeiteffekte hinsichtlich des Einflusses pränataler Stressereignisse auf die Stressantworten auf Verhaltens- und neuroendokriner Ebene im Sinne einer „epigenetischen Programmierung“ aufzeigen. Dabei sind insbesondere eine langfristige Überaktivierung der HPA-Antwort[28] verbunden mit einem veränderten Tag-Nacht-Rhythmus der Cortisolsekretion, sowie auch eine mögliche Beeinträchtigung der Schlafqualität und der affektiven Befindlichkeit zu nennen. Insofern ist - übertragen auf den Menschen - von einer Sensibilisierung „depressiver Bahnen“ auszugehen, wenn bei entsprechender Vulnerabilität bereits früh negative Beziehungserfahrungen (wie Vernachlässigung, Misshandlung) gemacht werden, welche die HPA-Achse aktivieren. Bei der Reifung des Gehirns und der Genexpression sowie der Nervenzellfunktion spielen insofern, wie bereits oben genannt, Umweltfaktoren sowie auch Bindungsverhalten eine Rolle. Wenn negative Bindungserfahrungen zu den oben genannten Entwicklungen beitragen, kann dem Vorhandensein von sicheren Bindungen jedoch im Umkehrschluss auch eine Pufferwirkung auf das sich entwickelnde Gehirn und hinsichtlich der späteren Resilienz und Anpassungsleistung zugeschrieben werden.
Komplikationen und Belastungen während Schwangerschaft und Geburt
Vermutlich erhöhen der Konsum von Alkohol und anderen Drogen während der Schwangerschaft sowie ein Sauerstoffmangel bei der Geburt das Risiko des Kindes, später an ADHS zu erkranken. Darüber hinaus werden auch zentralnervöse Infektionen, Schädelhirntraumen oder Verletzungen sowie Komplikationen während Schwangerschaft und Geburt mit späteren hyperkinetischen Auffälligkeiten assoziiert. Die Mehrheit der ADHS-betroffenen Kinder und Jugendlichen weist derartige Belastungen jedoch nicht auf; die genannten Komplikationen führen auch nicht immer zu ADHS.[29]
Tabakrauchen
Ein Zusammenhang der Korrelation zwischen pränatalem Tabakrauchen sowie Passivrauchen während der Kindheit und der Häufigkeit von ADHS konnte in einer 2009 veröffentlichten Studie anhand von 6.000 untersuchten Fällen belegt werden.[30] In anderen Studien konnten diese Ergebnisse jedoch nicht bestätigt werden.[31][32] Andere Annahmen gehen davon aus, dass die Sozialisation von Kindern rauchender Eltern lediglich eine andere sein könnte.
Siehe auch: Nikotin
Fluoride
Hauptartikel: Fluoride und ADHS
Eine Metastudie der Harvard School of Public Health und der Icahn School of Medicine aus dem Jahr 2014 kommt zu dem Schluss, dass Fluoride ab einer Konzentration von 0,9 und 11 mg/L im Trinkwasser neben anderen chemischen Stoffen möglicherweise unmittelbar an der Entstehung von ADHS und anderen benachbarten neurologischen Störungen, wie Autismus-Spektrum-Störungen und Legasthenie, beteiligt sein könnten.[33] So sollen außerdem die IQ der Kinder um etwa 7 Punkte niedriger liegen als bei Kindern, die in Gegenden mit geringerer Fluoridkonzentration (< 0,9 mg/L) leben. Kritiker wie der Universitätsprofessor David Coggon von der University of Southhampton sehen jedoch signifikante Schwachstellen sowohl in der durchgeführten Metastudie, als auch in vielen der 27 vornehmlich aus China stammenden Untersuchungen selbst, die für die Erstellung der Meta-Studie herangezogen wurden. Auch seien die von den Autoren gezogenen Schlüsse nicht überprüfbar und hätten eher spekulativen Charakter.[34]
Reizüberflutung
Hirnorganisch begründete Störungstheorien gehen davon aus, dass ADHS auf einer Reizüberflutung und einer allgemein mangelnden Fähigkeit, Störreize auszublenden, basiert. Empirische Studien konnten diese Übererregungshypothese jedoch nicht bestätigen.[35]
Bewegungsmangel
Es gibt keine Hinweise darauf, dass Bewegungsmangel allein als Auslöser für ADHS in Frage kommt. Dies bedeutet jedoch nicht, dass Bewegungsmangel nicht zur Verschlechterung einer vorhandenen ADHS-Symptomatik beitragen kann. Siehe auch: Sport
Siehe auch
- ADHS als genetische Normvariante
- Striatofrontale Dysfunktion
- Epidemiologie der ADHS
- Heilbarkeit der ADHS
- Dopamintransporter
- Fehldiagnosen
- Biomarker
- Ernährung
- Diagnostik
- Fluoride
- Nikotin
Film und Fernsehen
 ADHS - Ursachen und Behandlung (Dokumentation)
ADHS - Ursachen und Behandlung (Dokumentation) Aufmerksamkeitsprobleme verstehen (Lehrfilm)
Aufmerksamkeitsprobleme verstehen (Lehrfilm) Wirkung von Ritalin an den Synapsen (Lehrfilm)
Wirkung von Ritalin an den Synapsen (Lehrfilm)
Studien und wissenschaftliche Publikationen
 Ursachen von ADS - Genetische, neurologische und kognitive Ansätze (PDF)
Ursachen von ADS - Genetische, neurologische und kognitive Ansätze (PDF) Amygdala und Hippocampi in der strukturellen Kernspintomographie bei erwachsenen ADHS-Patienten im Vergleich zu Gesunden und Depressiven (PDF)
Amygdala und Hippocampi in der strukturellen Kernspintomographie bei erwachsenen ADHS-Patienten im Vergleich zu Gesunden und Depressiven (PDF) Bindung und ADHS - Kindliche und elterliche Bindungsrepräsentanzen bei ADHS (PDF)
Bindung und ADHS - Kindliche und elterliche Bindungsrepräsentanzen bei ADHS (PDF) Jeffrey, J. et al.: Clinically relevant biomarkers in autism spectrum disorders and attention deficit hyperactivity disorder (PDF)
Jeffrey, J. et al.: Clinically relevant biomarkers in autism spectrum disorders and attention deficit hyperactivity disorder (PDF)- Verhaltensprobleme prädizieren eine ADHS, Neuro-Depesche 11/2010
Weblinks
 Ursachen von ADS. Genetische, neurologische und kognitive Ansätze, Universität Bielefeld (PDF)
Ursachen von ADS. Genetische, neurologische und kognitive Ansätze, Universität Bielefeld (PDF)- ADHD Gene Database
- Faraone, S.: ADHD Genes Found. APSARD. 01.08.2016.
- NIMH - What Causes ADHD?
Literatur
- Döpfner,M., Lehmkuhl,G., Petermann,F. (2000). Hyperkinetische Störungen. Göttingen: Hogrefe-Verlag für Psychologie
- Johanna Krause, Klaus-Henning Krause: ADHS im Erwachsenenalter. Symptome – Differenzialdiagnose – Therapie. 4. vollst. akt. und erw. Auflage. Schattauer, Stuttgart 2014, ISBN 978-3-7945-2782-3
- Gerhard W. Lauth, Peter F. Schlottke: Training mit aufmerksamkeitsgestörten Kindern. 6., vollständig überarbeitete Auflage. Beltz, Weinheim 2009, ISBN 978-3-621-27675-7
- Simon Rückinger u. a.: Prenatal and Postnatal Tobacco Exposure and Behavioral Problems in 10-Year-Old Children. In: Environmental Health Perspectives, 1. Dezember 2009
- Silvia Schneider, Jürgen Margraf: Lehrbuch der Verhaltenstherapie: Störungen im Kindes- und Jugendalter. Springer Medizin Verlag, Heidelberg 2009, S. 412–428
Weitere interessante Artikel

- Medikamente
- Fehldiagnosen
- Mobbing und ADHS
- ADHS in den Medien
- Selbstwahrnehmung von ADHS-Betroffenen
- Divergentes Denken
- Hypoaktivität
- ADHS und Beruf
- Russell Barkley
- Stigmatisierung und ADHS
- ADHS und Schule
- Zentrales ADHS-Netz
- ADHS und Straßenverkehr
- ADHS als soziales Konstrukt
- Bekannte Persönlichkeiten
- Kritik und Kontroversen
- Progressive Muskelrelaxation nach Jacobson
- Kausalattribuierung und ADHS
- Hyperfokus
- Hunter-/Farmer-Theorie
- Ritalin
- Cannabis
- ADHS bei Erwachsenen
Einzelnachweise
- ↑ Johanna Krause, Klaus-Henning Krause: ADHS im Erwachsenenalter. Symptome – Differenzialdiagnose – Therapie. 4. vollst. akt. und erw. Auflage. Schattauer, Stuttgart 2014, ISBN 978-3-7945-2782-3, S. 44 f.
- ↑ vgl. http://www.zentrales-adhs-netz.de/fuer-therapeuten/faqs.html?cHash=71e51a92763fcd67a2c0f43c6647ac27&tx_irfaq_pi1[cat]=5
- ↑ Brain Matures a Few Years Late in ADHD, But Follows Normal Pattern / NIMH
- ↑ Lou HC, Andresen J, Steinberg B, McLaughlin T, Friberg L (Jan 1998). "The striatum in a putative cerebral network activated by verbal awareness in normals and in ADHD children". Eur J Neurol 5 (1): 67–74
- ↑ http://www.nimh.nih.gov/science-news/2007/gene-predicts-better-outcome-as-cortex-normalizes-in-teens-with-adhd.shtml
- ↑ Dougherty DD, Bonab AA, Spencer TJ, Rauch SL, Madras BK, Fischman AJ (1999). "Dopamine transporter density in patients with attention deficit hyperactivity disorder". Lancet 354 (9196): 2132––33.
- ↑ Dresel SH, Kung MP, Plössl K, Meegalla SK, Kung HF (1998). "Pharmacological effects of dopaminergic drugs on in vivo binding of [99mTc]TRODAT-1 to the central dopamine transporters in rats". European journal of nuclear medicine 25 (1): 31–9.
- ↑ http://www.bundesaerztekammer.de/fileadmin/user_upload/downloads/ADHSLang.pdf
- ↑ http://www.lwl.org/psychiatrie-marsberg-download/PDF/Trost_neu.pdf
- ↑ Lauth, G., Minsel, W.-R.: „ADHS bei Erwachsenen“, S. 27.
- ↑ Silvia Schneider, Jürgen Margraf: Lehrbuch der Verhaltenstherapie: Störungen im Kindes- und Jugendalter. Springer Medizin Verlag, Heidelberg 2009, S. 412–428
- ↑ http://aktuelles.uni-frankfurt.de/forschung/6-millionen-fuer-eu-projekt-zur-adhs-behandlung/
- ↑ Faraone SV, Biederman J: Neurobiology of attention-deficit hyperactivity disorder. Biol Psychiatry 1998; 44 (10):951-58.
- ↑ Thapar A, Holmes J, Poulton K, Harrington R: Genetic basis of attention deficit and hyperactivity. Br J Psychiatry 1999; 174: 105-11
- ↑ Lauth, G., Minsel, W.-R.: „ADHS bei Erwachsenen“, S. 27.
- ↑ Asherson P, IMAGE-Consortium: Attention-deficit hyperactivity disorder in the post-genomic era. Eur Child Adolesc Psychiatry 2004; 13 (suppl 1):I150-70.
- ↑ Sprich S, Biederman J, Crawford MH, Mundy E, Faraone SV:Adoptive and biological families of children and adolescents with ADHD. J Am AcadChild Adolesc Psychiatry 2000; 39(11): 1432-37.
- ↑ Asherson P, IMAGE-Consortium: Attention-deficit hyperactivity disorder in the post-genomic era. Eur Child Adolesc Psychiatry 2004; 13 (suppl 1):I150-70.
- ↑ Gonon, F.: The dopaminergic hypothesis of attention-deficit/hyperactivity disorder needs re-examining. Trends Neurosci. 2009 Jan;32(1):2-8.
- ↑ Kahn RS, Khoury J, Nichols WC, Lanphear BP: Role of dopamine transporter genotypeand maternal prenatal smoking in childhood hyperactive-impulsive, inattentive, and op-positional behaviors. J Pediatr 2003; 143 (1): 104-10.
- ↑ Johanna Krause, Klaus-Henning Krause: ADHS im Erwachsenenalter. Symptome – Differenzialdiagnose – Therapie. 4. vollst. akt. und erw. Auflage. Schattauer, Stuttgart 2014, ISBN 978-3-7945-2782-3, S. 44 f..
- ↑ Eberhard Kruk: Soziale Determinanten psychischer Erkrankungen. In: Max-Planck-Institut für Sozialrecht und Sozialpolitik (Hrsg.): Tätigkeitsbericht 2010–2011. München 2012, S. 105
- ↑ Biederman, J., Milberger, S., Faraone, S.V., Kiely, K., Guite, J., Mick, E., Ablon, S., Warburton, R., Reed, E., 1995. Family-environment risk factors for attention-deficit hyperactivity disorder. A test of Rutter's indicators of adversity. Arch Gen Psychiatry. 52, 464-70
- ↑ Cierpka, M.; Lück, M.;Strüber, D. & Roth, G. (Hrsg.) (2007). Zur Ontogenese aggressivenVerhaltens. Zeitschrift Psychotherapeut, 52, S. 87-101
- ↑ http://oops.uni-oldenburg.de/1384/1/Bachelor_Arbeit_Deprivation_Kathrin_Schierenbeck_final_.pdf
- ↑ Shore A.N. Atttachment, Affect Reglation, and the Devoloping Brain. Pediatrics in Review 2005; 26 (7): 204-2011
- ↑ sowie nachfolgender Absatz vgl. https://goo.gl/0LVxIl
- ↑ Hypothalamus-Hypophysen-Nebennierenrinden-Achse, weitere Informationen
- ↑ http://www.neurologen-und-psychiater-im-netz.org/kinder-jugend-psychiatrie/erkrankungen/aufmerksamkeitsdefizit-hyperaktivitaets-stoerung-adhs/ursachen/
- ↑ Simon Rückinger u. a.: Prenatal and Postnatal Tobacco Exposure and Behavioral Problems in 10-Year-Old Children. In: Environmental Health Perspectives, 1. Dezember 2009, PMC 2831960
- ↑ A. Thapar u. a.: Prenatal smoking might not cause attention-deficit/hyperactivity disorder: evidence from a novel design. In: Biological psychiatry. 66, Nr. 8, Oktober 2009, S. 722–727
- ↑ Langley u. a.: Maternal and paternal smoking during pregnancy and risk of ADHD symptoms in offspring: testing for intrauterine effects. In: American journal of epidemiology. 176, Nr. 3, August 2012, S. 261–268
- ↑ http://www.thelancet.com/journals/laneur/article/PIIS1474-4422%2813%2970278-3/abstract
- ↑ http://www.rawstory.com/rs/2014/02/14/disputed-study-links-fluoride-other-chemicals-to-erosion-of-child-iqs/
- ↑ http://adhspedia.de/Downloads/studien/Ursachen_von_ADS_Genetische_neurologische_und_kognitive_Ansaetze.PDF

